
- 日韓学生シンポジウム
2008年11月22日〜11月25日
その未来は、
地球の明日とつながっている。
固体酸化物形燃料電池SOFCの
基盤研究に挑む!

写真2 雨澤准教授(左)、井口助教
燃料の持つ化学エネルギーを
電気エネルギーに変換。
燃料電池は、使用する電解質の種類やイオン導電種の違いにより、大きく4つの種類に分けられます。
- 固体酸化物形燃料電池
(Solid Oxide Fuel Cell:SOFC) - リン酸形燃料電池
(Phosphoric Acid Fuel Cell:PAFC) - 溶融炭酸塩形燃料電池
(Molten Carbonate Fuel Cell:MCFC) - 固体高分子形燃料電池
(Polymer Electrolyte Fuel Cell:PEFC)
上記のほかに、特殊用途に実用化されているものとして、純水素と純酸素で発電するアルカリ形(スペースシャトル用電源に使われている)、軍事用のヒドラジン※3を燃料とするものがあります。
4つのなかで、最も発電効率が高いものとされるのが「固体酸化物形燃料電池(以下、SOFC)」。これからSOFCの発電の仕組みについてご説明しましょう。ちょっと難しくなりますがお付き合いください。
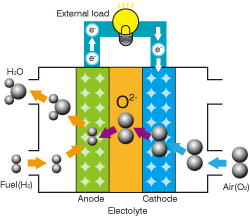
図1 固体酸化物形燃料電池 発電の仕組み
図1をご覧ください。この構造は、酸素イオン(O2−)のみを通す固体電解質が、2種類のガス(燃料(H2)と空気(O2))にはさまれた形になっています。固体電解質の両端には電流を取り出す電極が取り付けられていますが、燃料側のそれを燃料極(アノード)、空気側を空気極(カソード)と呼びます。
動作原理は、①空気極(右側)に入った酸素O2は電極で電子を受け取り酸素イオンO2−になる。②O2−は電解質中を移動していき、燃料極(左側)で電子を放すとともにH2と反応し水H2Oを生む。③これらの電気化学反応により、外部回路に電流を取り出すことができる、というものです。酸素イオンが移動する駆動力は、すなわち燃料極と空気極の酸素ポテンシャル差によります。水素の燃焼によるエネルギーを、直接、電力として外部に取り出すわけですから、電池というより小型発電機のイメージに近いでしょうか。
燃料電池のメリットはいくつか挙げられますが、中でも大きいのは「化学エネルギーを直接、電気エネルギーに変換するので高効率である」「小型な発電施設(家庭用やマンション用等)でも高効率な発電が可能である」ということです。
火力発電を例にとって比較してみると、電気的エネルギーを取り出すまでに幾度かのエネルギー変換を経るために、多くのエネルギーロス(損失)が生じています。
化学的エネルギー(石油の燃焼反応)
↓
熱エネルギー(ボイラーでの水の沸騰)
↓
運動エネルギー(タービンの回転)
↓
電気的エネルギー(発電機による発電)
燃料電池は前述の通り、化学的エネルギーを直接電気的エネルギーに変換するので非常に高効率です。
他の利点としては「CO2排出量の少ないクリーンな発電システムであること」もあります。“環境の世紀”にふさわしいエネルギーシステムですね。そして「稼動部がないため、騒音や振動がない」という点も見逃せません。
- ※3
- hydrazine。無機化合物の一種。引火性があり、ロケットや航空機の燃料として用いられる。燃料電池の燃料としても模索されている。


